Era un primaveral miércoles 16 de abril de 1947 cuando en el puerto de la ciudad de Texas (Estados Unidos) se desataba un incendio en la bodega del barco Grandcamp que provocó una tremenda explosión. Un día después de incendiarse, y por efecto dominó, se originó en un segundo buque que estaba amarrado a 250 metros de distancia, el High Flyer, la detonación de las sustancias químicas que transportaba. La violencia del estruendo se llevó por delante la vida de 581 trabajadores que había en el muelle. Fueron 3.500 los heridos y 150 millones de dólares las pérdidas que ocasionó. Por tanto, se considera la mayor tragedia industrial de los Estados Unidos.
Pasaban las 9:00 de la mañana de otro fatídico miércoles de abril, esta vez un 19, pero casi medio siglo más tarde, en 1995, cuando un tipo raro que vestía chaleco de combate, jeans negros y botas militares hacía detonar a distancia el camión bomba que había estacionado unos minutos antes frente al Edificio Federal Alfred P. Murrah, en Oklahoma City (Estados Unidos). Un tercio de la estructura se vino abajo, matando a 168 personas (entre ellas 19 niños que jugaban en esos momentos en una guardería del edificio) e hiriendo a casi 700.
Aparte de haberse desatado en tan particular día de la semana del mes primaveral por excelencia y de ocurrir ambos en territorio americano, estos dos acontecimientos tienen un elemento en común. En el primer caso, la explosión se produjo cuando los trabajadores del buque Grandcamp acababan de cargar nitrato de amonio; un producto granulado destinado a ser utilizado como fertilizante, aunque había sido usado por el ejército de los Estados Unidos como parte integrante de sus explosivos durante una Segunda Guerra Mundial concluida tan solo dos años antes. Un cigarrillo arrojado descuidadamente sobre la carga provocaba un incendio que se propagó a las aproximadamente 2.300 toneladas embaladas en sacos de papel. El fuego desatado en la bodega del buque propició un calentamiento de la carga y su posterior explosión. Por efecto dominó originó otra explosión en un segundo buque cargado con más de 1.000 toneladas de azufre y con 960 de nitrato amónico.
En el atentado de Oklahoma, la bomba casera de 2.300 kilogramos que confeccionó Timothy McVeigh, sargento y exsoldado americano de la Guerra del Golfo, estaba formada por nitrometano, un combustible altamente volátil, gasóleo y 1.800 kilos de nitrato de amonio. A esta mezcla se le conoce comúnmente como ANFO, por sus siglas en inglés: Amonium Nitrate and Fuel Oil.
El ANFO es un explosivo de alta potencia que se prepara mezclando nitrato de amonio al 90-97 por ciento con un 3-10 de combustible, que puede ser gasolina, gasóleo o queroseno. El ANFO comenzó a emplearse en la ingeniería civil allá por la década de los años cincuenta, pues era mucho más barato y seguro que otros explosivos.
Te interesa: Contenedores antiexplosivos: en qué consisten y cuál es su utilidad.
Nitrato de amonio
Como podemos ver de estos dos ejemplos, un fertilizante como el nitrato de amonio, que puede ayudar a los seres humanos a combatir el hambre en el mundo proporcionando cosechas más fértiles, puede también propiciar su destrucción.
Su fórmula molecular es NH4NO3. Por tanto, posee átomos de nitrógeno, hidrógeno y oxígeno, lo que justifica sus propiedades comburentes.
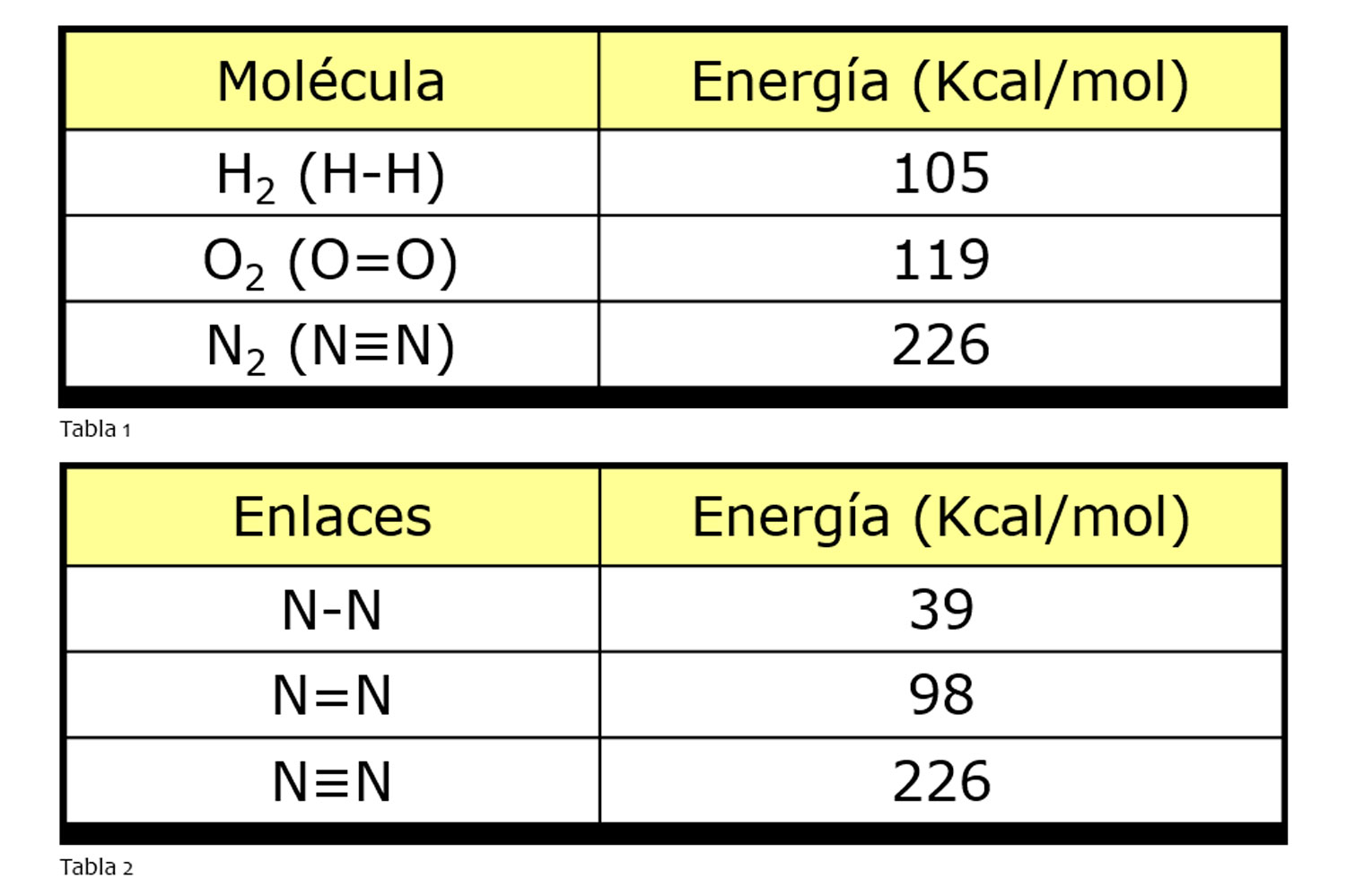
Un solitario átomo de nitrógeno es demasiado reactivo, por lo que tiende a unirse a otro que encuentre mediante un muy fuerte y estable enlace covalente triple (N N), formando la molécula N2 (que es como se encuentra en el aire). En la tabla 1 se representa la energía de enlace, en kilocalorías por mol, de tres gases monoatómicos muy comunes: el hidrógeno, el oxígeno y el nitrógeno. Como podemos ver, es el enlace químico más fuerte de los tres; aunque en realidad es el mayor existente entre dos átomos iguales.
Romper la molécula de nitrógeno molecular (N2) conlleva, pues, un considerable esfuerzo. Transformar el nitrógeno molecular del aire para formar nitrato de amonio precisa del dos por ciento de toda la energía producida en el mundo. Por eso, la molécula de N2 permanece inalterable cuando la respiramos o cuando el ser humano intenta combinarla con cualquier otro elemento en condiciones normales de presión y temperatura.
En el nitrato de amonio, los átomos de nitrógeno están unidos al oxígeno y al hidrógeno mediante enlaces dobles o simples, más débiles que el triple enlace N2 de la molécula del aire. Y es precisamente la combinación NO3 (grupo nitrato) la que hace al nitrato de amonio tan peligroso. No en vano, explosivos muy usados como el trinitrotolueno (TNT), la nitroglicerina o la nitrocelulosa tienen todos ellos la unión NO como parte integrante de su composición química.
Como podemos ver en la tabla 2, estas uniones tienen menor energía de enlace, por lo que son más inestables cuando se les aplica energía.
Cuando la molécula de una sustancia sólida como el nitrato de amonio recibe calor se rompen los enlaces químicos de sus átomos, tendiendo los de nitrógeno a unirse entre ellos para formar moléculas de nitrógeno gas, N2, más estables y fuertes. Esta rápida transformación química de una sustancia sólida a gas, favorecida por el oxígeno presente, puede tener carácter explosivo y exotérmico. Y esto es lógico; de la misma manera que se empleó mucha energía para la síntesis del nitrato de amonio, su descomposición devuelve al medio gran parte de esa energía cuando se forman enlaces más fuertes y duraderos.
Grandes incidentes
Faversham (Reino Unido), Kriewald (Polonia), New Jersey, Oregón, Iowa y Kansas City (Estados Unidos), Ludwigshafen-Oppau (Alemania), Tessenderlo (Bélgica), Brest y Toulouse (Francia), Oulu (Finlandia), Queensland (Australia), Xinping (China) o Barracas (Castellón) fueron escenarios donde la descomposición del nitrato de amonio provocó grandes pérdidas en materiales y en vidas, algunas de ellas bomberos.
Un último accidente ocurría el 4 de agosto de 2020. Se hacía un hueco informativo en unos noticiarios que desde hacía seis meses acaparaban casi en exclusiva la evolución mortífera de la pandemia del COVID. Muchos de los edificios del puerto de Beirut (Líbano) saltaban por los aires y la mitad de la ciudad resultaba dañada a consecuencia de la tremenda explosión de las 2.750 toneladas de nitrato de amonio almacenadas en un hangar.
El siniestro dejó un cráter de 120 metros de diámetro, mató a 202 personas e hirió a otras 6.500. El detonante de la tragedia pudo haber sido la ignición de unos fuegos artificiales. Diez mil millones de dólares en pérdidas, casi la totalidad de los hoteles de Beirut destruidos y tres hospitales totalmente devastados fueron algunas de las consecuencias materiales del accidente. Así que, como se dice en la jerga de las emergencias: «Cuando tienes entre manos sustancias peligrosas acabadas en ‘ato’ o ‘ito’… ‘cuidadito’».